ปัญหาด้านสรีรวิทยาการบินที่สำคัญ มักจะเกี่ยวข้องกับการเปลี่ยนแปลงของความกดบรรยากาศ ปริมาตรของก๊าซ และอุณหภูมิ ดังนั้นจึงจำเป็นที่จะต้องทำความรู้ และเข้าใจถึงธรรมชาติของก๊าซในเรื่องต่างๆ ซึ่งก็คือ กฎของก๊าซ นั่นเอง
กฎของบอยล์ (Boyle's Law)
"ปริมาตรของก๊าซจะเปลี่ยนแปลงเป็นปฏิภาคกลับกับความกดดันของก๊าซนั้น เมื่ออุณหภูมิคงที่"
นั่นคือ : P1 V2
P2 = V1
เมื่อ P1 = ความกดดันของก๊าซครั้งแรก
P2 = ความกดดันของก๊าซครั้งหลัง
V1 = ปริมาตรของก๊าซครั้งแรก
V2 = ปริมาตรของก๊าซครั้งหลัง
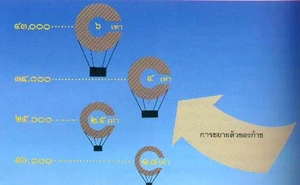
ตัวอย่าง : บัลลูนลูกหนึ่งบรรจุก๊าซไว้ ๑,๐๐๐ ลบ.ซม. ที่ระดับน้ำทะเล ซึ่งมีความกดบรรยากาศ ๗๖๐ มม.ปรอท ครั้นเมื่อบัลลูน ลูกนี้ขึ้นไปอยู่ที่ระยะสูง ๑๘,๐๐๐ ฟุตจากระดับน้ำทะเล ซึ่งมีความกดดันของบรรยากาศ ๓๘๐ มม.ปรอท ก๊าซซึ่งบรรจุไว้จะกลายเป็น ๒,๐๐๐ ลบ.ซม. หากอุณหภูมิคงที่ตลอดเวลา
กฎของบอยล์ นำมาใช้อธิบายปรากฏการณ์ที่ก๊าซในโพรงต่างๆ ของร่างกาย เช่น หูชั้นกลาง โพรงไซนัส ปอด ทางเดินอาหารเกิดการขยายตัวขึ้นเมื่อทำการบินสู่ระยะสูงทำให้เกิดอาการปวดหู ปวดไซนัส หรือปวดท้องได้
กฎของดาลตัน (Dalton's Law)
"ความกดดันของก๊าซผสม ย่อมเท่ากับผลบวกของความกดดันของก๊าซแต่ละอย่างที่เป็นส่วนประกอบของก๊าซผสมนั้น"
นั่นคือ : Pt = P1+P2+...Pn
เมื่อ : Pt = ความกดดันของก๊าซผสม
P1,P2...,Pn = ความกดดันของก๊าซแต่ละอย่าง
ตัวอย่าง : บรรยากาศประกอบด้วยก๊าซที่สำคัญคือ ออกซิเจน และไนโตรเจน ที่ระดับน้ำทะเลมีความกดดันบรรยากาศ ๗๖๐ มม.ปรอท โดยเป็นความกดดันของออกซิเจน ๑๕๒ มม. ปรอท และของไนโตรเจน ๖๐๘ มม.ปรอท เป็นต้น
กฎของดาลตัน ใช้อธิบายปรากฏการณ์ของการเกิดภาวะพร่องออกซิเจน ถึงแม้ว่าปริมาตรของออกซิเจนจะมีค่าคงที่ประมาณร้อยละ ๒๑ ในบรรยากาศก็ตาม แต่เมื่อขึ้นไปที่ระยะสูงความกดบรรยากาศลดลง ทำให้ความกดดันของออกซิเจนลดลงเป็นสัดส่วนกัน จึงทำให้มีความกดดันของออกซิเจนไม่เพียงพอต่อความต้องการของร่างกาย
กฎของเฮนรี (Henry's Law)
"ปริมาณของก๊าซที่ละลายอยู่ในของเหลวจะเปลี่ยนแปลงเป็นปฏิภาคโดยตรงกับความกดดันของก๊าซที่กระทำเหนือของเหลว"
นั่นคือ : P1 A1
P2 = A2
เมื่อ P1 = ความกดดันของก๊าซครั้งแรก
P2 = ความกดดันของก๊าซครั้งหลัง
A1 = ปริมาตรของก๊าซที่ละลายอยู่ในของเหลวครั้งแรก
A2 = ปริมาตรของก๊าซที่ละลายอยู่ในของเหลวครั้งหลัง
ตัวอย่าง : หากคนๆ หนึ่งมีก๊าซละลายอยู่ในเลือด ๑,๐๐๐ ลบ.ซม. ที่ระดับน้ำทะเล เมื่อคนผู้นั้นขึ้นไปอยู่ที่ระยะสูง ๑๘,๐๐๐ ฟุต จากระดับน้ำทะเลซึ่งมีความกดของบรรยากาศลดลงเหลือ ๓๘๐ มม.ปรอท ทำให้ปริมาณของก๊าซที่สามารถละลายอยู่ในเลือดลดลงเหลือเพียง ๕๐๐ ลบ.ซม. ส่วนก๊าซที่เหลืออีก ๕๐๐ ลบ.ซม. จะแยกตัวออกจากเลือดแล้วหลุดลอยออกไปเป็นฟองก๊าซ
กฎของเฮนรี ใช้อธิบายปรากฏการณ์ที่ก๊าซซึ่งละลายอยู่ในของเหลวในร่างกาย แยกตัวออกมาเป็นฟองก๊าซไปรบกวนการทำงานของร่างกายส่วนต่างๆ
กฎของชาร์ลส (Charle's Law)
"ความกดดันของก๊าซจะเปลี่ยนแปลงเป็นปฏิภาคโดยตรงกับอุณหภูมิของก๊าซนั้น เมื่อปริมาตรคงที่"
นั่นคือ : P1 T1
P2 = T2
เมื่อ P1 = ความกดดันของก๊าซครั้งแรก
P2 = ความกดดันของก๊าซครั้งหลัง
T1 = อุณหภูมิของก๊าซครั้งแรก
T2 = อุณหภูมิของก๊าซครั้งหลัง
ตัวอย่าง : ออกซิเจนในถังประจำเครื่องบินมีความกดดัน ๔๕๐ ปอนด์ต่อ ตร.นิ้ว เมื่อทำการบินที่ระยะสูง ๑๘,๐๐๐ ฟุต ที่มีอุณหภูมิ ๒๑ องศาเซลเซียส (อุณหภูมิมาตรฐานที่ระดับน้ำทะเล คือ ๑๕ องศาเซลเซียส ตามตารางแสดงความกดบรรยากาศและอุณหภูมิที่ระยะสูงต่างๆ และในการคำนวณตามกฎนี้ ใช้ค่าอุณหภูมิเป็นองศา K ซึ่ง ๑ องศาเซลเซียส มีค่าเท่ากับ ๒๗๓ องศา K) ความกดดันของออกซิเจนในถังจะเหลือเพียง ๓๙๖ ปอนด์ต่อตร.นิ้ว
กฎนี้ไม่มีความสำคัญต่อสรีรวิทยาของมนุษย์เนื่องจากร่างกายคนเรามีอุณหภูมิคงที่อยู่เสมอแต่ใช้อธิบายถึงการที่ความกดดันของออกซิเจน ในถังลดลงเมื่อขึ้นไปสู่ระยะสูง ถึงแม้ว่าจะยังไม่ได้มีการเปิดใช้เลยก็ตาม
กฎการแพร่กระจายของก๊าซ (Law of Gaseous Diffusion)
"ก๊าซอย่างเดียวกันเมื่อถูกกั้นด้วยเยื่อที่ซึมผ่านได้ (Permeable Membrane) จะกระจายออกจากบริเวณที่มีความกดดันสูงไปสู่บริเวณที่มีความกดดันต่ำ จนกระทั่งความกดดันเท่ากัน"
กฎข้อนี้ใช้อธิบายให้ทราบถึงการแลกเปลี่ยนของก๊าซ ระหว่างอากาศที่หายใจเข้าไปในปอดกับก๊าซในกระแสโลหิตที่ไหลเวียนมาฟอกที่ปอด และระหว่างก๊าซในกระแสโลหิตกับเซลล์ต่างๆ ของร่างกาย ในการนำเอาออกซิเจนไปใช้ประโยชน์
