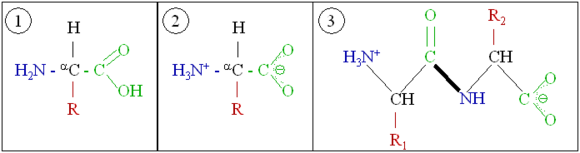
กรดอะมิโน (amino acid) คือ ชีวโมเลกุลที่มีทั้งหมู่ฟังก์ชันอะมิโนและคาร์บอกซิลเป็นส่วนประกอบ กรดอะมิโนเป็นองค์ประกอบสำคัญของโปรตีนซึ่งเป็นส่วนประกอบสำคัญที่มีอยู่ในสิ่งมีชีวิตทุกชนิด ในวิชาชีวเคมี คำว่า "กรดอะมิโน" มักหมายความถึงกรดอะมิโนแบบแอลฟา (alpha animo acids) ซึ่งเป็นกรดอะมิโนที่ทั้งหมู่อะมิโนและหมู่คาร์บอกซิลติดอยู่กับคาร์บอนอะตอมเดียวกัน เรียกว่า -คาร์บอน
เรซิดีวของกรดอะมิโน (amino acid residue) คือกรดอะมิโนที่ถูกดึงโมเลกุลของน้ำออกไปหนึ่งโมเลกุล (ไฮโดรเจนไอออนหนึ่งไอออนจากหมู่อะมิโน และไฮดรอกไซด์ไอออนหนึ่งไอออนจากหมู่คาร์บอกซิล) เรซิดีวของกรดมักเกิดขึ้นในขณะสร้างพันธะเปปไทด์
โครงสร้างทั่วไป
กรดอะมิโนเป็นหน่วยก่อสร้างโครงสร้างพื้นฐานของโปรตีน โดยสร้าง พอลิเมอร์ ที่เป็นโซ่สั้นๆ เรียกว่า เปปไทด์ หรือ พอลิเปปไทด์ และกลายเป็นโครงสร้างที่เรียกว่าโปรตีน โครงสร้างทั่วไปของโปรตีโนเจนิก แอลฟ่า อะมิโน แอซิด คือ:
COOH | H-C-R | NH2
หมู่ "R" แทน โซ่ข้าง (side chain) หรือหมู่ฟังก์ชัน ซึ่งมีความเฉพาะสำหรับกรดอะมิโนแต่ละตัว กรดอะมิโนแบ่งตามคุณสมบัติของหมู่ฟังก์ชัน ได้เป็น
- หมู่ฟังชั่นไม่มีขั้ว และไม่ชอบน้ำ (hydrophobic) ได้แก่ ไกลซีน อะลานีน วาลีน ลิวซีน ไอโซลิวซีน และโพรลีน กรดอะมิโนเหล่านี้มีบทบาทในการทำปฏิกิริยากับส่วนที่ไม่ชอบน้ำของโปรตีน และเพิ่มความยืดหยุ่นของโปรตีน
- หมู่ฟังก์ชันเป็นอะโรมาติก ไฮโดรคาร์บอน ได้แก่ ฟีนิลอะลานีน ไทโรซีน และทริปโตแฟน มีบทบาทในการเพิ่มความแข็งแรงของโปรตีนโดยการซ้อนทับกับของวงแหวนอะโรมาติกซึ่งมีความคงตัว
- หมู่ฟังก์ชันมีขั้ว ไม่มีประจุ ได้แก่ เซอรีน ทรีโอนีน ซิสทีอีน เมทไทโอนีน กลูตามีน แอสปาราจีน หมู่ฟังก์ชันเหล่านี้ชอบน้ำ (hydrophilic) และละลายในน้ำได้ดี
- หมู่ฟังก์ชันประจุลบ ได้แก่ แอสปาเตต และกลูตาเมต โดยจะแตกตัวให้ประจุลบที่ pH 7
- หมู่ฟังก์ชันประจุบวก ได้แก่ ไลซีน อาร์จินีน ฮิสทีดีน โดยจะแตกตัวให้ประจุบวกที่ pH 7
กรดอะมิโน 20 ตัวถูกตั้งรหัสโดยมาตรฐานรหัสพันธุกรรม และถูกเรียกว่า โปรตีโนเจนิก หรือกรดอะมิโนมาตรฐาน นอกเหนือจากกรดอะมิโน 20 ชนิดที่เป็นองค์ประกอบของโปรตีนแล้ว ยังพบกรดอะมิโนอื่นๆอีก เช่น
- ในโครงสร้างของโปรตีน มีกรดอะมิโนที่ดัดแปลงโครงสร้างไปจากกรดอะมิโน 20 ชนิดข้างต้น ตัวอย่างเช่น
- เดสโมซิน (desmosine) พบในเส้นใยอีลาสติน
- ซีลีโนซิสทีอีน มีหมู่ Se แทนที่ O ในโมเลกุลของซิสทีอีน พบในโมเลกุลของเอนไซม์ กลูตาไทโอน เปอรอกซิเดส (Glutathione peroxidase)
- ไทโรซีน (thyrosine) พบในไทโอโกลบบูลินที่สังเคราะห์โดยต่อมธัยรอยด์
- กรดอะมิโนอะดิปิก (aminoadipic acid) พบในโปรตีนในข้าวโพด
- มีอีกอย่างน้อย 2 ตัวที่กำหนดรหัสโดย DNA ซึ่งเป็นวิธีที่ไม่ได้มาตรฐานดังนี้:
- ซีลีโนซิสตีอีน (Selenocysteine) ถูกใส่เข้าไปในโปรตีนบางตัวที่ UGA โคดอน, ซึ่งเป็นโคดอนสำหรับหยุด
- ไพร์โรไลซีน (Pyrrolysine) ถูกใช้โดย เมตทาโนเจน (methanogen) บางตัวใน เอนไซม์ ที่มันใช้สำหรับผลิตมีเทน มันถูกกำหนดรหัสให้เหมือน ซีลีโนซิสตีอีน แต่กับ UGA โคดอน แทน
- กรดอะมิโนและอนุพันธ์ที่ไม่เป็นองค์ประกอบของโปรตีน แต่มีหน้าที่สำคัญทางชีวภาพอื่น เช่น
- กาบา (GABA) เป็นสารส่งสัญญาณประสาท
- อีพิเนปพริน (Epinephrine) เป็นฮอร์โมนที่สร้างมาจากไทโรซีน
- เพนิซิลลามีน (Penicillamine) เป็นส่วนประกอบของเพนนิซิลิน
- ไกลซีน และ กลูตาเมต เป็นสารส่งผ่านประสาท (neurotransmitters)
- คาร์นิตีน (carnitine) ใช้ประโยชน์ในการขนย้าย ลิพิด ภายใน เซลล์
- ออร์นิทีน (ornithine)
- ซิตรูลลีน (citrulline)
- โฮโมซิสตีอิน (homocysteine)
- ไฮดรอกซิโพรลีน (hydroxyproline)
- ไฮดรอกซิไลซีน (hydroxylysine)
- ซาร์โคซีน (sarcosine)
- กรดอะมิโนหลายตัวสามารถใช้สังเคราะห์โมเลกุลอื่นได้ เช่น:
- ทริปโตแฟน (tryptophan) เป็น สารตั้งต้น ของสารส่งผ่านประสาท เซอโรโทนิน (serotonin) ;
- ไกลซีน (glycine) เป็นหนึ่งใน ตัวทำปฏิกิริยา ในกระบวนการสังเคราะห์ พอร์ไฟริน (porphyrins) เช่น ฮีม (heme)
- กรดอะมิโนอื่นที่มีในโปรตีนธรรมดาเกิดขึ้นโดย การปรับแต่งหลังทรานสเลชัน, (post-translational modification) คือปรับแต่งหลัง ทรานสเลชัน ใน การสังเคราะห์โปรตีน การปรับแต่งเหล่านี้บ่อยครั้งมีความสำคัญต่อหน้าที่ของโปรตีน เช่น
- โปรลีน (Proline) เป็นกรดโปรตีโนเจนิกอะมิโน เท่านั้นที่ หมู่ข้าง เป็นไซคลิก และเชื่อมต่อกับ หมู่ เอ-อะมิโน เกิดเป็นหมู่ทุติยภูมิอะมิโน เดิมทีโปรลีนถูกเข้าใจผิดเรียกเป็น กรดอิมิโน
กรดอะมิโนจำเป็น
บางตัวใน 20 ตัวของกรดอะมิโนมาตรฐานเรียกว่า กรดอะมิโนจำเป็น (essential amino acid) เพราะว่ามันไม่สามารถสังเคราะห์ ได้โดย ร่างกาย แต่ได้จาก สารประกอบ ผ่าน ปฏิกิริยาเคมี ซึ่งเราได้รับโดยการกินเข้าไป ใน มนุษย์ กรดอะมิโนจำเป็นได้แก่
- ไลซีน (lysine)
- ลิวซีน (leucine)
- ไอโซลิวซีน (isoleucine)
- เมตไทโอนีน (methionine)
- ฟีนิลอะลานีน (phenylalanine)
- ทรีโอนีน (threonine)
- ทริปโตแฟน (tryptophan)
- วาลีน (valine)
- ในเด็กมีเพิ่มอีก 2 ตัว ดังนี้
- ฮีสติดีน (histidine)
- อาร์จินีน (arginine)
ลักษณะทางโครงสร้าง
ไอโซเมอริซึม (Isomerism)
ยกเว้น ไกลซีน ซึ่งมีหมู่ฟังก์ชัน R = H กรดอะมิโนที่เกิดขึ้นเป็นไปได้ที่จะมี 2 ออพติคัล ไอโซเมอร์ เรียกว่า D และ L กรดอะมิโน L จะแทนกรดอะมิโนจำนวนมากมายที่พบใน โปรตีน กรดอะมิโน D พบใน โปรตีน ที่ผลิตจากสิ่งมีชีวิตที่อาศัยอยู่ในทะเลชนิดพิเศษ เช่น หอยทากกรวย (cone snail) และพบเป็นส่วนประกอบจำนวนมากของ ผนังเซลล์ (cell wall) ของ แบคทีเรีย
ปฏิกิริยา (Reactions)
โปรตีนจะถูกสร้างโดยกระบวนการ พอลิเมอไรเซชัน ของกรดอะมิโนโดย พันธะเปปไทด์ ในกระบวนการที่เรียกว่า ทรานสเลชัน (translation)
แหล่งที่มา : https://th.wikipedia.org/wiki/กรดอะมิโน